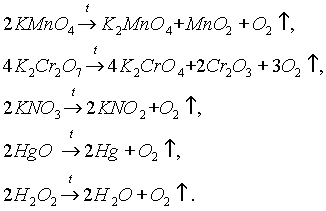
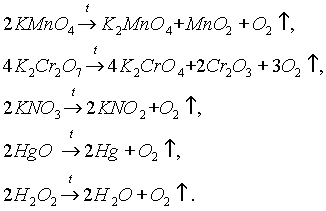
Сложные вещества при определенных условиях также взаимодействуют с кислородом. При этом образуются оксиды, а в некоторых случаях - оксиды и простые вещества:
Кислород как окислитель. По величине относительной электроотрицательности кислород является вторым элементом после фтора. Поэтому в химических реакциях, как с простыми, так и со сложными веществами он является окислителем (принимает электроны).
Горение, ржавление, гниение и дыхание протекают при участии кислорода. Это окислительно-восстановительные процессы.
Получение. В промышленности кислород получают:
1. фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается);
2. электролизом воды:
катод: 2 Н 2 О + 2 е - → Н 2 + 2 ОН -
анод: 2 Н 2 О – 4е - → О 2 + 4 Н +
В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов:
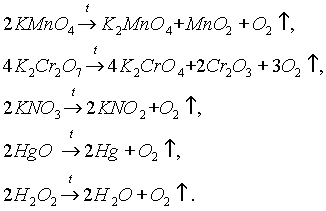
Особенно легко кислород выделяется в результате последней реакции, поскольку в пероксиде водорода H 2 O 2 не двойная, а одинарная связь между атомами кислорода -О-О-.
В частности, пероксиды щелочных металлов используют на космических станциях для обеспечения космонавтов кислородом за счет его регенерации из выдыхаемого СО 2:
2 К 2 О 2 + 2 СО 2 → 2 К 2 СО 3 + О 2
Применение. Кислород применяется для получения высоких температур. Температура кислородно-ацетиленового пламени достигает 3500 °С, кислородно-водородного - 3000 °С.
В медицине кислород применяется для облегчения дыхания больных (кислородные подушки и палатки). Он используется в кислородных приборах при выполнении работ в трудной для дыхания атмосфере (подземные и подводные работы, высотные и космические полеты и др.)
Озон. Молекула кислорода состоит из двух атомов O 2 . Химическая связь в ней - ковалентная неполярная, а молекула озона состоит из трех атомов кислорода О 3 . Молекула озона диамагнитна. И хотя кислород и озон образованы одним и тем же элементом, свойства их различны.
Озон - газ с характерным резким, но приятным запахом синеватого цвета, в жидком виде – тёмно-синий. Он является еще более сильным окислителем, чем кислород О 2 . Озон образуется в атмосфере при грозовых разрядах, чем объясняется специфический запах свежести после грозы.
В лабораториях озон получают пропусканием разряда через кислород (реакция эндотермическая):
Также он образуется в верхних слоях атмосферы под действием ультрафиолетовых лучей.
Обратная реакция разложения озона протекает с выделением энергии (выделяется энергии столько, сколько и поглощается): О 3 ↔ О 2 + Q
При взаимодействии озона с раствором иодида калия выделяется иод, тогда как с кислородом эта реакция не идет:
Реакция часто используется как качественная для обнаружения ионов I или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся иодом. Реакция качественная еще и потому, что озон не окисляет ионы Сl и Вг .
При присоединении одного электрона к молекуле О 3 образуется озонид- ион: О 3 +1е - → О 3 – . Поэтому при действии О 3 на щелочные металлы или их гидроксиды образуются озониды:
О 3 + Na → NaO 3
O 3 + NaOH (тв) → NaO 3 + O 2 + H 2 O.
Озониды очень сильные окислители, при хранении разлагаются:
NaO 3 → NaO 2 + О 2
В воде бурно выделяется кислород:
NaO 3 + Н 2 О → NaOH + O 2
Озон разрушает органические вещества, окисляет многие металлы, в том числе золото и платину, а также производит белящее и дезинфицирующее действие.
Тема: Вещества и их превращения
Урок: Химические свойства кислорода
Кислород поддерживает процессы дыхания и горения. В кислороде горят многие неметаллы. Например, уголь горит на воздухе, взаимодействуя при этом с кислородом. В результате этой реакции образуется углекислый газ и выделяется теплота. Из курса физики вы знаете, что теплота обозначается буквой «Q». Если в результате реакции теплота выделяется, то в уравнении пишут «+Q», если поглощается – то «-Q».
Теплота, которая выделяется или поглощается в ходе химической реакции, называется тепловым эффектом химической реакции .
Реакции, протекающие с выделением теплоты, называются экзотермическими .
Реакции, протекающие с поглощением теплоты, называются эндотермическими .
Запишем уравнение реакции горения угля на воздухе:
С + О 2 = СО 2 + Q
Если сжечь уголь в сосуде с кислородом, то в этом случае уголь сгорит быстрее, чем на воздухе. То есть, скорость горения угля в кислороде выше, чем на воздухе.
Рис. 1. Горение угля в кислороде
Сера тоже горит на воздухе, при этом также выделяется теплота. Значит, реакцию взаимодействия серы с кислородом можно назвать экзотермической. В чистом кислороде сера сгорает быстрее, чем на воздухе.
Запишем уравнение реакции горения серы в кислороде, если при этом образуется оксид серы (IV):
S + O 2 = SO 2 + Q

Рис. 2. Горение серы в кислороде
Аналогично, можно провести реакцию горения фосфора на воздухе или в кислороде. Эта реакция также является экзотермической. Запишем ее уравнение, если в результате образуется оксид фосфора (V):
4Р + 5О 2 = 2Р 2 О 5 + Q

Рис. 3. Горение фосфора в кислороде
В атмосфере кислорода могут гореть некоторые металлы. Например, железо сгорает в кислороде с образованием железной окалины:
3Fe + 2O 2 = Fe 3 O 4 +Q

Рис. 4. Горение железа в кислороде
А вот медь не горит в кислороде, а окисляется кислородом при нагревании. При этом образуется оксид меди (II):
2. Единая коллекция цифровых образовательных ресурсов ().
Домашнее задание
1. с.68-70 №№ 2,5,6,7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2. с.60 №№ 5,7 из учебника Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 8кл.», 2009 г.
Данный урок посвящен изучению химических свойств простого вещества кислорода. Из материалов урока вы узнаете, что такое «тепловой эффект химической реакции», какие реакции называют экзотермическими, а какие – эндотермическими.
Тема: Вещества и их превращения
Урок: Химические свойства кислорода
Кислород поддерживает процессы дыхания и горения. В кислороде горят многие неметаллы. Например, уголь горит на воздухе, взаимодействуя при этом с кислородом. В результате этой реакции образуется углекислый газ и выделяется теплота. Из курса физики вы знаете, что теплота обозначается буквой «Q». Если в результате реакции теплота выделяется, то в уравнении пишут «+Q», если поглощается – то «-Q».
Теплота, которая выделяется или поглощается в ходе химической реакции, называется тепловым эффектом химической реакции .
Реакции, протекающие с выделением теплоты, называются экзотермическими .
Реакции, протекающие с поглощением теплоты, называются эндотермическими .
Запишем уравнение реакции горения угля на воздухе:
С + О2 = СО2 + Q
Если сжечь уголь в сосуде с кислородом, то в этом случае уголь сгорит быстрее, чем на воздухе. То есть, скорость горения угля в кислороде выше, чем на воздухе.
Рис. 1. Горение угля в кислороде
Сера тоже горит на воздухе, при этом также выделяется теплота. Значит, реакцию взаимодействия серы с кислородом можно назвать экзотермической. В чистом кислороде сера сгорает быстрее, чем на воздухе.
Запишем уравнение реакции горения серы в кислороде, если при этом образуется оксид серы (IV):
S + O2 = SO2 + Q

Рис. 2. Горение серы в кислороде
Аналогично, можно провести реакцию горения фосфора на воздухе или в кислороде. Эта реакция также является экзотермической. Запишем ее уравнение, если в результате образуется оксид фосфора (V):
4Р + 5О2 = 2Р2О5 + Q

Рис. 3. Горение фосфора в кислороде
В атмосфере кислорода могут гореть некоторые металлы. Например, железо сгорает в кислороде с образованием железной окалины:
3Fe + 2O2 = Fe3O4 +Q

Рис. 4. Горение железа в кислороде
А вот медь не горит в кислороде, а окисляется кислородом при нагревании. При этом образуется оксид меди (II):
Кислород способен реагировать не только с простыми, но и со сложными веществами.
Природный газ метан сгорает в кислороде с образованием оксида углерода (IV) и воды:
CH4 + 2O2 = CO2 + 2H2O + Q
При неполном сгорании метана (в условиях недостаточного количества кислорода) образуется не углекислый, а угарный газ СО. Угарный газ – ядовитое вещество, чрезвычайно опасное для человека, т. к. человек не ощущает его отравляющего действия, а медленно засыпает с потерей сознания.
Реакции простых и сложных веществ с кислородом называют окислением . При взаимодействии простых и сложных веществ с кислородом, как правило, образуются сложные вещества, состоящие из двух элементов, одним из которых является кислород. Эти вещества называются оксидами.
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П. А. Оржековского и др. «Химия. 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.70-74)
2. Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с.68-70)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.:Астрель, 2012. (§21)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005. (§28)
5. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§20)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Тесты по химии (онлайн) .
2. Единая коллекция цифровых образовательных ресурсов.
3. Alhimik. ru .
4. Himhelp. ru .
Домашнее задание
1. с.68-70 №№ 2,5,6,7 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2. с.60 №№ 5,7 из учебника Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия: 8кл.», 2009 г.
Кислород из марганцовки и тлеющая лучина