ОПРЕДЕЛЕНИЕ
Кислород
- восьмой элемент Периодической таблицы. Обозначение - О от латинского «oxygenium». Расположен во втором периоде, VIА группе. Относится к неметаллам. Заряд ядра равен 8.
Кислород - самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Массовая доля кислорода в земной коре составляет около 47%.
В виде простого вещества кислород представляет собой бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0 o С растворяют 4,9, а при 20 o С - 3,1 объема кислорода.
Атомная и молекулярная масса кислорода
ОПРЕДЕЛЕНИЕ
Относительная атомная масса A r
- это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12 (12 С).
Относительная атомная масса атомарного кислорода равна 15,999 а.е.м.
ОПРЕДЕЛЕНИЕ
Относительная молекулярная масса M r
- это молярная масса молекулы, отнесенная к 1/12 молярной массы атома углерода-12 (12 С).
Это безразмерная величина.Известно, что молекула кислорода двухатомна - О 2 . Относительная молекулярная масса молекулы кислорода будет равна:
M r (О 2) = 15,999 × 2 ≈32.
Аллотропия и аллотропные модификации кислорода
Кислород может существовать в виде двух аллотропных модификаций - кислорода О 2 и озона О 3 (физические свойства кислорода описаны выше).
При обычных условиях озон - газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при (-111,9 o С).
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при 0 o С растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением:
3O 2 = 2O 3 - 285 кДж.
Изотопы кислорода
Известно, что в природе кислород может находиться в виде трех изотопов 16 O (99,76%), 17 O (0,04%) и 18 O (0,2%). Их массовые числа равны 16, 17 и 18 соответственно. Ядро атома изотопа кислорода 16 O содержит восемь протонов и восемь нейтронов, а изотопов 17 O и 18 O- такое же количество протонов,девять и десять нейтронов соответственно.
Существует двенадцать радиоактивных изотопов кислорода с массовыми числами от 12-ти до 24-х, из которых наиболее стабильным является изотоп 15 О с периодом полураспада равным 120 с.
Ионы кислорода
На внешнем энергетическом уровне атома кислорода имеется шесть электронов, которые являются валентными:
1s 2 2s 2 2p 4 .
Схема строения атома кислорода представлена ниже:
В результате химического взаимодействия кислород может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
О 0 +2e → О 2- ;
О 0 -1e → О 1+ .
Молекула и атом кислорода
Молекула кислорода состоит из двух атомов - О 2 . Приведем некоторые свойства, характеризующие атом и молекулу кислорода:
Примеры решения задач
ПРИМЕР 1
Это искусственно полученные и очень ценные в практическом отношении вещества - хлорфторуглеводороды разного состава, например такие:Эти вещества получают при реакциях замещения галогенами атомов водорода в углеводородах. Хлорфторуглеводороды - стойкие вещества, не растворяются в воде, неядовиты, не горят, не вызывают коррозии, отличные изоляторы. Из них делают утеплители для стен зданий, одноразовую посуду для горячих напитков. Жидкие вещества из этой группы (фреоны) - хоро-шие растворители, эффективные хладоагенты в холодильниках и кондиционерах. Их применяют в аэрозольных баллончиках как безвредные растворители специальных веществ, в системах ав-томатического пожаротушения (CBrF 3).Производство этих веществ развивалось ускоренными темпа-ми до тех пор, пока не обнаружили, что они, попадая в страто-сферу, разрушают озон (Сейчас стараются заменить фреоны на менее летучие вещества. Например, в качестве хладоагентов ис-пользуют фторхлорметан, а для аэрозольных баллонов применя-ют сжиженные газообразные предельные углеводороды).До стратосферы эти вещества доходят без изменений. Ведь они химически устойчивы. А в стратосфере, где много ультрафи-олетового излучения, их молекулы разрушаются, при этом от-щепляются активные атомы галогена, в частности хлора:
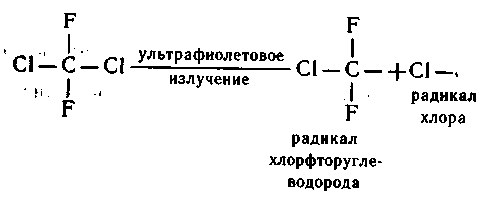
Одноатомный хлор-радикал реагирует с озоном:0 3 + Сl = О 2 + СlO
озон хлор кислород оксид (радикал) хлора (II)Под действием ультрафиолетовых лучей из озона образуется кислород, который в момент выделения также бывает в актив-ном одноатомном состоянии: 0 3 = 0 2 + Оозон кислород атомарный
кислородОксид хлора (II) реагирует с
атомарным кислородом, и тогда вновь образуется хлор-радикал, который опять разрушает озон; происходит,
цепная реакция, повторяющаяся многократно:СlO + О = Сl + О 2оксид атомарный хлор кислородхлора (II) кислород (радикал)О 3 + С1= О 2 + СlOОдин атом хлора участвует в серии таких реакций и может разрушить до 100000 молекул озона. Хлор может «выйти из иг-ры» тогда, когда ему встретится молекула метана. Тогда он, присоединив к себе один атом водорода из метана, образует хлороводород, который при растворении в воде образует
соляную кислоту. Так хлор-разрушитель возвращается на Землю в виде кислотного дождя:СН 4 + 2С1 - СН 3 С1 + НС1метан хлор хлор хлороводород (радикал) метан (в растворе - соляная кислота)Даже если производство хлорфторуглеводородов будет повсе-местно сокращено, процесс разрушения озонового слоя над всей планетой будет продолжаться. Обедненный озоном воздух посте-пенно рассеивается, газы в атмосфере перемешиваются, содер-жащиеся в воздухе хлорфторуглеводороды будут еще очень дол-го, не менее чем 100 лет, продолжать свою работу, разрушаю-щую озон.В 1990 г. представители правительства 92 стран в Лондоне подписали соглашение о полном прекращении производства хлорфторуглеводородов к 2000 г. Соблюдение этого соглашения будет условием постепенного восстановления природного содер-жания озона в цтратосфере, потому что концентрация уже по-павшего в атмосферу хлора должна со временем уменьшаться, однако это время - столетие.
IX.
Заключение.
Итак, мы получили различные сведения из области химии элементов VI группы и в большей степени о кислороде, узнали о том, где и как применяют и получают кислород, также узнали о воздействии кислорода на нашу жизнь,
народное хозяйство и культуру.Если после чтения моего реферата у вас возникло желание по-ближе познакомиться с необъятной областью той науки, откуда почерпнуты сведения по элементам VI группы пе-риодической системы Д. И. Менделеева, то я выпол-нила свою задачу.
X. Литература.
1.
Химия. Для школьников ст. классов и поступающих в вузы: Учеб. Пособие / Н. Е. Кузьменкою, В. В. Еремин, В. А. Попков - 4-е изд., стереотип. - М.: Дрофа, 2001. - 544 с.:ил.
2.
Книга для чтения по неорганической химии. Кн. для учащихся. В 2 ч. Ч. 1 / сост. В. А. Крицман - 3-е изд. - М.: Просвещение, 1993. - 192 с., 8 л ил.: ил. - ISBN 5-09-002972-5
3.
Химия. Учеб. для 9 кл. сред. шк. / Ф. Г. Фельдман, Г. Е. Рудзитис - М.: Просвещение, 1990. - 176 с.: ил. ISBN 5-09-002624-6
4.
(латинское Oxygenium)
О,
химический элемент VI группы периодической системы Менделеева; атомный номер 8, атомная масса 15,9994. При нормальных условиях К. - газ без цвета, запаха и вкуса. Трудно назвать другой элемент, который играл бы на нашей планете такую
важную роль, как К.
Историческая справка. Процессы горения и дыхания издавна привлекали внимание учёных. Первые указания на то, что не весь воздух, а лишь «активная» его часть поддерживает горение, обнаружены в китайских рукописях 8 в. Много позже Леонардо да Винчи (1452-1519) рассматривал воздух как смесь двух газов, лишь один из которых расходуется при горении и дыхании. Окончательное открытие двух главных
составных частей воздуха - Азота и К., сделавшее эпоху в науке, произошло только в конце 18 в. (см. Химия,
Исторический очерк). К. получили почти одновременно К. Шееле (1769-70) путём прокаливания селитр (KNO3, NaNO3), двуокиси марганца MnO2 и других веществ и Дж. Пристли (1774) при нагревании сурика Pb3O4 и окиси ртути HgO. В 1772 Д. Резерфорд открыл азот. В 1775 А. Лавуазье, произведя количественный анализ воздуха, нашёл, что он «состоит из двух (газов) различного и, так сказать, противоположного характера», т. е. из К. и азота. На основе широких экспериментальных исследований Лавуазье правильно объяснил горение и дыхание как процессы взаимодействия веществ с К. Поскольку К. входит в состав кислот, Лавуазье назвал его oxygene, т. е. «образующий кислоты» (от греческого oxys - кислый и gennao - рождаю; отсюда и
русское название «кислород»).
Распространение в природе. К. - самый распространённый химический элемент на Земле. Связанный К. составляет около 6/7 массы
водной оболочки Земли - гидросферы (85,82% по массе), почти половину литосферы (47% по массе), и только в атмосфере, где К. находится в свободном состоянии, он занимает второе место (23,15% по массе) после азота.
К. стоит на первом месте и по числу образуемых им минералов (1364); среди минералов, содержащих К., преобладают силикаты (полевые шпаты, слюды и др.), кварц, окислы железа, карбонаты и сульфаты. В живых организмах в среднем около 70% К.; он входит в состав большинства важнейших органических соединений (белков, жиров, углеводов и т.д.) и в состав неорганических соединений скелета. Исключительно велика роль свободного К. в биохимических и физиологических процессах, особенно в дыхании (См. Дыхание). За исключением некоторых микроорганизмов-анаэробов, все животные и растения получают необходимую для жизнедеятельности энергию за счёт окисления биологического (См. Окисление биологическое)
различных веществ с помощью К.
Вся масса свободного К. Земли возникла и сохраняется благодаря жизнедеятельности зелёных растений суши и Мирового океана, выделяющих К. в процессе Фотосинтеза. На земной поверхности, где протекает фотосинтез и господствует свободный К., формируются резко окислительные условия. Напротив, в магме, а также глубоких горизонтах
подземных вод, в илах морей и озер, в болотах, где свободный К. отсутствует, формируется восстановительная среда. Окислительно-восстановительные процессы с участием К. определяют концентрацию многих элементов и образование месторождений полезных ископаемых - угля, нефти, серы, руд железа, меди и т.д. (см. Круговорот веществ). Изменения в круговорот К. вносит и
хозяйственная деятельность человека. В некоторых промышленных странах при сгорании топлива расходуется К. больше, чем его выделяют растения при фотосинтезе. Всего же на сжигание топлива в мире ежегодно потребляется около 9·109 т К.
Изотопы, атом, молекула. К. имеет три устойчивых изотопа: 16О, 17O и 18O, среднее содержание которых составляет соответственно 99,759%, 0,037% и 0,204% от
общего числа атомов К. на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16O связано с тем, что ядро атома 16O состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории
атомного ядра, обладают особой устойчивостью.
В соответствии с положением К. в периодической системе элементов (См. Периодическая система элементов) Менделеева электроны атома К. располагаются на двух оболочках: 2 - на внутренней и 6 - на внешней (конфигурация 1s22s22p4 см. Атом). Поскольку
внешняя оболочка атома К. не заполнена, а потенциал ионизации и сродство к электрону составляют соответственно 13,61 и 1,46 эв, атом К. в химических соединениях обычно приобретает электроны и имеет отрицательный эффективный заряд. Напротив, крайне редки соединения, в которых электроны отрываются (точнее оттягиваются) от атома К. (таковы, например, F2O, F2O2). Раньше, исходя единственно из положения К. в периодической системе, атому К. в окислах и в большинстве других соединений приписывали отрицательный заряд (-2). Однако, как показывают экспериментальные данные, ион O2- не существует ни в свободном состоянии, ни в соединениях, и отрицательный эффективный заряд атома К. практически никогда существенно не превышает единицы.
В обычных условиях молекула К. двухатомна (O2); в тихом электрическом разряде образуется также трёхатомная молекула O3 - озон; при
высоких давлениях обнаружены в небольших количествах молекулы O4
Электронное строение O2 представляет большой теоретический интерес. В основном состоянии молекула O2 имеет два неспаренных электрона; для неё неприменима «обычная» классическая
структурная формула О=О с двумя двухэлектронными связями (см. Валентность). Исчерпывающее объяснение этого факта дано в рамках теории молекулярных орбиталей. Энергия ионизации молекулы К. (O2 - е>О2+) составляет 12,2 эв, а сродство к электрону (O2 + е > O2-) - 0,94 эв. Диссоциация молекулярного К. на атомы при обычной температуре ничтожно мала, она становится заметной лишь при 1500 °С; при 5000 °С молекулы К. почти полностью диссоциированы на атомы.
Физические свойства. К. - бесцветный газ, сгущающийся при -182,9 °С и нормальном давлении в бледно-синюю жидкость, которая при -218,7 °С затвердевает, образуя синие кристаллы. Плотность газообразного К. (при 0°С и нормальном давлении) 1,42897 г/л. Критическая температура К. довольно низка tkpит = -118,84 °С), т. е. ниже, чем у Cl2, CO2, SO2 и некоторых других газов; Ркрит = 4,97 Мн/м2 (49,71 am). Теплопроводность (при 0 °С) 23,8610-3 вт/(м К), т. е. 5710-6 кал/сек см °С). Молярная теплоёмкость (при 0 °С) в дж/(моль К) Ср = 28,9, Cv = 20,5; в кал/(моль oC) Ср = 6,99, Cv = 4,98; Cp/Cv = 1,403. Диэлектрическая проницаемость газообразного К. 1,000547 (0 °С), жидкого 1,491. Вязкость 189 мпуаз (0 °С). К. мало растворим в воде: при 20 °С и 1 am в 1 м3 воды растворяется 0,031 м3, а при 0 °С - 0,049 м3 К. Хорошими твёрдыми поглотителями К. являются платиновая чернь и активный древесный уголь.
Химические свойства. К. образует химические соединения со всеми элементами, кроме лёгких инертных газов (См. Инертные газы). Будучи наиболее активным (после фтора) неметаллом, К. взаимодействует с большинством элементов непосредственно; исключение составляют тяжелые инертные газы, галогены, золото и платина; их соединения с К. получают
косвенным путем. Почти все реакции К. с другими веществами - реакции окисления экзотермичны, т. е. сопровождаются выделением энергии. С Водородом при обычных температурах К. реагирует крайне медленно, выше 550 °С эта реакция идёт со взрывом: 2Н2 + O2 = 2H2O. С серой (См. Сера), Углеродом, Азотом, Фосфором К. взаимодействует при обычных условиях очень медленно. При повышении температуры скорость реакции возрастает и при некоторой, характерной для каждого элемента температуре воспламенения начинается горение. Реакция азота с К. благодаря особой прочности молекулы N2 эндотермична и становится заметной лишь выше 1200 °С или в электрическом разряде: N2+O2 = 2NO. К. активно окисляет почти все металлы, особенно легко - щелочные и щёлочноземельные. Активность взаимодействия металла с К. зависит от многих факторов - состояния поверхности металла, степени измельчения, присутствия примесей (см. Алюминий, Железо, Хром и т.д.).
В процессе взаимодействия вещества с К. исключительно важна роль воды. Например, даже такой активный металл, как Калий, с совершенно лишённым влаги К. не реагирует, но воспламеняется в К. при обычной температуре в присутствии даже ничтожных количеств паров воды. Подсчитано, что в результате коррозии (См. Коррозия) ежегодно теряется до 10% всего производимого металла.
Окиси некоторых металлов, присоединяя К., образуют перекисные соединения, содержащие 2 или более связанных между собой атомов К. Так, перекиси Na2O2 и ВаО2 включают перекисный ион O22-, надперекиси NaO2 и KO2 - ион O2-, а озониды NaO3, KO3, RbO3 и CsO3 - ион O3-. К. экзотермически взаимодействует со многими сложными веществами. Так, аммиак горит в К. в отсутствии катализаторов, реакция идёт по уравнению: 4NH3 + 3O2 = 2N2 + 6Н2О. Окисление аммиака кислородом в присутствии катализатора даёт NO (этот процесс используют при получении азотной кислоты (См.
Азотная кислота)).
Особое значение имеет горение углеводородов (
природного газа, бензина, керосина) - важнейший источник тепла в быту и промышленности, например СН4+2О2 = СО2+2Н2О. Взаимодействие углеводородов с К. лежит в основе многих важнейших
производственных процессов - такова, например, так называемая конверсия метана, проводимая для получения водорода: 2СН4+О2+2Н2О=2СО2+6Н2 (см. Конверсия газов). Многие органические соединения (углеводороды с двойной или тройной связью, альдегиды, фенолы, а также скипидар, высыхающие масла и др.) энергично присоединяют К. Окисление К.
питательных веществ в клетках служит источником энергии живых организмов.
Получение. Существует 3 основных способа получения К.: химический, электролизный (электролиз воды) и физический (разделение воздуха).
Химический способ изобретён ранее других. К. можно получать, например, из бертолетовой соли KClO3, которая при нагревании разлагается, выделяя O2 в количестве 0,27 м3 на 1 кг соли. Окись бария BaO при нагревании до 540 °С сначала поглощает К. из воздуха, образуя перекись BaO2, а при последующем нагревании до 870 °С BaO2 разлагается, выделяя чистый К. Его можно получать также из KMnO4, Ca2PbO4, K2Cr2O7 и других веществ при нагревании и добавлении катализаторов (См. Катализаторы). Химический способ получения К. малопроизводителен и дорог, промышленного значения не имеет и используется лишь в лабораторной практике.
Электролизный способ состоит в пропускании постоянного
электрического тока через воду, в которую для повышения её электропроводности добавлен раствор едкого натра NaOH. При этом вода разлагается на К. и водород. К. собирается около положительного электрода электролизёра, а водород - около отрицательного. Этим способом К. добывают как побочный продукт при производстве водорода. Для получения 2 м3 водорода и 1 м3 К. затрачивается 12-15 квт ч электроэнергии.
Разделение воздуха является основным методом получения К. в современной технике. Осуществить разделение воздуха в нормальном газообразном состоянии очень трудно, поэтому воздух прежде сжижают, а затем уже разделяют на составные части. Такой способ получения К. называют разделением воздуха методом глубокого охлаждения. Сначала воздух сжимается компрессором, затем, после прохождения теплообменников, расширяется в машине-Детандере или дроссельном вентиле, в результате чего охлаждается до температуры 93 К (-180 °С) и превращается в жидкий воздух. Дальнейшее разделение жидкого воздуха, состоящего в основном из
жидкого азота и жидкого К., основано на различии температуры кипения его компонентов . При постепенном испарении жидкого воздуха сначала выпаривается преимущественно азот, а остающаяся жидкость всё более обогащается К. Повторяя подобный процесс многократно на ректификационных тарелках воздухоразделительных колонн (см. Ректификация), получают жидкий К. нужной чистоты (концентрации). В СССР выпускают мелкие (на несколько л) и самые крупные в мире кислородные воздухоразделительные установки (на 35000 м3/ч К.). Эти установки производят технологический К. с концентрацией 95-98,5%, технический - с концентрацией 99,2-99,9% и более чистый, медицинский К., выдавая продукцию в жидком и газообразном виде. Расход
электрической энергии составляет от 0,41 до 1,6 квт ч/м3.
К. можно получать также при разделении воздуха по методу избирательного проницания (диффузии) через перегородки-мембраны. Воздух под
повышенным давлением пропускается через фторопластовые, стеклянные или пластиковые перегородки, структурная решётка которых способна пропускать молекулы одних компонентов и задерживать другие. Этот способ получения К. пока (1973) используется лишь в лабораториях.
Газообразный К. хранят и транспортируют в стальных баллонах и ресиверах при давлении 15 и 42 Мн/м2 (соответственно 150 и 420 бар, или 150 и 420 am), жидкий К. - в металлических сосудах Дьюара или в специальных цистернах-танках. Для транспортировки жидкого и газообразного К. используют также специальные трубопроводы. Кислородные баллоны окрашены в голубой цвет и имеют чёрную надпись «кислород».
Применение. Технический К. используют в процессах газопламенной обработки металлов, в сварке (См. Сварка), кислородной резке (См. Кислородная резка), поверхностной закалке (См. Закалка), металлизации (См. Металлизация) и др., а также в авиации, на подводных судах и пр. Технологический К. применяют в
химической промышленности при получении искусственного жидкого топлива, смазочных масел, азотной и серной кислот, метанола, аммиака и аммиачных удобрений, перекисей металлов и др.
химических продуктов. Жидкий К. применяют при взрывных работах (см. Оксиликвиты), в реактивных двигателях и в лабораторной практике в качестве хладагента.
Заключенный в баллоны чистый К. используют для дыхания на больших высотах, при комических полетах, при подводном плавании и др. В медицине К. дают для вдыхания тяжелобольным, применяют для приготовления кислородных, водяных и воздушных (в кислородных палатках) ванн, для
внутримышечного введения и т.п. (см. Кислородная терапия).
В. Л. Василевский, И. П. Вишнев, А. И. Перельман.
К. в металлургии широко применяется для интенсификации ряда пирометаллургических процессов. Полная или частичная замена поступающего в металлургические агрегаты воздуха кислородом изменила химизм процессов, их теплотехнические параметры и технико-экономические показатели. Кислородное дутьё позволило сократить потери тепла с уходящими газами, значительную часть которых при воздушном дутье составлял азот. Не принимая существенного участия в химических процессах, азот замедлял течение реакций, уменьшая концентрацию активных реагентов окислительно-восстановительной среды. При продувке К. снижается расход топлива, улучшается качество металла, в металлургических агрегатах возможно получение новых видов продукции (например, шлаков и газов необычного для
данного процесса состава, находящих специальное техническое применение) и др.
Первые опыты по применению дутья, обогащенного К., в доменном производстве для выплавки передельного чугуна и ферромарганца были проведены одновременно в СССР и Германии в 1932-33. Повышенное содержание К. в доменном дутье сопровождается большим сокращением расхода последнего, при этом увеличивается содержание в доменном газе окиси углерода и повышается его теплота сгорания. Обогащение дутья К. позволяет повысить производительность доменной печи, а в сочетании с газообразным и жидким топливом, подаваемым в горн, приводит к снижению расхода кокса. В этом случае на каждый дополнительный процент К. в дутье производительность увеличивается примерно на 2,5%, а расход кокса снижается на 1%.
К. в мартеновском производстве в СССР сначала использовали для интенсификации сжигания топлива (в промышленном масштабе К. для этой цели впервые применили на заводах «Серп и молот» и «Красное Сормово» в 1932-33). В 1933 начали вдувать К. непосредственно в жидкую ванну с целью окисления примесей в период доводки. С повышением интенсивности продувки расплава на 1 м3/т за 1 ч производительность печи возрастает на 5-10%, расход топлива сокращается на 4-5%. Однако при продувке увеличиваются потери металла. При расходе К. до 10 м3/т за 1 ч выход стали снижается незначительно (до 1%). В мартеновском производстве К. находит всё большее распространение. Так, если в 1965 с применением К. в мартеновских печах было выплавлено 52,1% стали, то в 1970 уже 71%.
Опыты по применению К. в электросталеплавильных печах в СССР были начаты в 1946 на заводе «Электросталь». Внедрение кислородного дутья позволило увеличить производительность печей на 25-30%, снизить удельный расход электроэнергии на 20-30%, повысить качество стали, сократить расход электродов и некоторых дефицитных легирующих добавок. Особенно эффективной оказалась подача К. в электропечи при производстве нержавеющих сталей с низким содержанием углерода, выплавка которых сильно затрудняется вследствие науглероживающего действия электродов. Доля электростали, получаемой в СССР с использованием К., непрерывно растет и в 1970 составила 74,6% от
общего производства стали.
В ваграночной плавке обогащенное К. дутьё применяется главным образом для высокого перегрева чугуна, что необходимо при производстве высококачественного, в частности высоколегированного, литья (кремнистого, хромистого и т.д.). В зависимости от степени обогащения К. ваграночного дутья на 30-50% снижается расход топлива, на 30-40% уменьшается содержание серы в металле, на 80-100% увеличивается производительность вагранки и существенно (до 1500 °С) повышается температура выпускаемого из неё чугуна.
О значении К. в конвертерном производстве см. в ст. Кислородно-конвертерный процесс.
К. в цветной металлургии получил распространение несколько позже, чем в чёрной. Обогащенное К. дутьё используется при конвертировании штейнов, в процессах шлаковозгонки, вельцевания (См. Вельцевание), агломерации (См. Агломерация) и при отражательной плавке медных концентратов. В свинцовом, медном и никелевом производстве кислородное дутьё интенсифицировало процессы шахтной плавки, позволило снизить расход кокса на 10-20%, увеличить проплав на 15-20% и сократить кол-во флюсов в отдельных случаях в 2-3 раза. Обогащение К. воздушного дутья до 30% при обжиге цинковых сульфидных концентратов увеличило производительность процесса на 70% и уменьшило объём отходящих газов на 30%. Разрабатываются новые высокоэффективные процессы плавки сульфидных материалов с применением чистого К.: плавка в кислородном факеле, конвертирование штейнов в вертикальных конвертерах, плавка в жидкой ванне и др.
С. Г. Афанасьев.
Лит.: Чугаев Л. А., Открытие кислорода и теория горения в связи с
философскими учениями древнего мира, Избр. труды, т. 3, М., 1962, с. 350; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., т. 1-3, М., 1969; Некрасов Б. В., Основы общей химии, т. 1, М., 1965; Кислород. Справочник, под ред. Д. Л. Глизманенко, ч. 1-2, М., 1967; Разделение воздуха методом глубокого охлаждения, под ред. В. И. Епифановой, Л. С. Аксельрода, т. 1-2, М., 1964; Справочник по физико-техническим основам глубокого охлаждения, М. - Л., 1963.
Кислород
(лат Oxygenium, от греч. oxys кислый и gennao - рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Природный кислород состоит из трех стабильных . 16 О (99,759%), 17 О (0,037%) и 18 О (0,204%]. Конфигурация внешней электронной оболочки 2s 2 2p
; энергии ионизации О°:О + :О 2+ равны соответственно 13,61819, 35,118 эВ; по Полингу 3,5 (наиболее электроотрицательный элемент после F); 1,467 эВ; 0,066 нм. Молекула кислород двухатомна. Существует также аллотропная модификация кислорода – озон
О 3 . Межатомное расстояние в молекуле О 2 0,12074 нм; энергия ионизации О 2 12,075 эВ; сродство к электрону 0,44 эВ; энергия 493,57 кДж/моль, константа К р
=p O 2 /p O2 составляет 1,662.10 -1 при 1500 К, 1,264.10 -2 при 3000 К, 48,37 при 5000 К; О 2 (в скобках указаны координац. числа) 0,121 нм (2), 0,124 нм (4), 0,126 нм (6) и 0,128 нм (8).
В основном состоянии (триплетное ) два валентных молекулы О 2 , находящиеся на разрыхляющих p х
и p у, не спарены, благодаря чему кислород .агнитен (единств, .агнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. температуре (закон Кюри). Существуют два долгоживущих О 2 - синглетное 1 D g (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное (энергия возбуждения 156,8 кДж/моль).
Кислород - наиболее распространенный элемент на Земле. В содержится 23,10% по массе (20,95% по объему) свободного кислорода, в и литосфере - соотв. 85,82 и 47% по массе связанного кислорода. Известно более 1400 . в состав которых входит кислород. Убыль кислорода в в результате . в т. ч. , гниения и дыхания, возмещается выделением кислорода растениями при . Кислород входит в состав всех веществ, из которых построены живые организмы; в организме человека его содержится окислород 65%.
Свойства. Кислород - бесцветный без запаха и вкуса. Т. кип. 90,188 К, температура 54,361 К; плотность при 273 К и нормальном 1,42897 г/л, плотн. (в кг/м 3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); t крит 154,581 К, р
крит 5.043 МПа, d крит 436,2 кг/м 3 ; С 0 p 29,4 Дж/(моль.К); DH 0 исп 6,8 кДж/моль (90,1 К); S
O 299
205,0 Дж/моль.К); уравнение температурной зависимости давления . в интервале 54-150 К lgp
(гПа)=7,1648-377,153/T; 0,02465 Вт/(м.К) при 273 К; h 205,23 10 -7 Па.с (298 К).
Жидкий кислород окрашен в голубой цвет; плотность 1,14 г/см 3 (90,188 К); C O p 54,40 Дж/(моль.К); 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10 -2 Па.с; g 13,2.10 -5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10 -3 (1 - T/154,576) 11/9 Н/м; n D
1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магнитная восприимчивость 7,699.10 -3 (90,1 К).
Твердый кислород существует в нескольких кристаллических модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрированной ромбической решеткой (при 21 К и 0,1 МПа а
= 0,55 нм, b=
0,382 нм, с=0,344 нм, плотн. 1,46 г/см 3), при 23,89-43,8 К-b-форма с гексаген, кристаллической решеткой (при 28 К и 0,1 МПа а
= 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а
= 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный кислород: температура 283 К, давление 5,0 ГПа; DH O пл 443 Дж/молъ; ур-ние температурной зависимости плотности d=
1,5154-0,004220T г/см 3 (44 54 К), a-, b- и g- О 2 светло-синего цвета. Модификация р антиферромагнитна, a и g .агнитны, их магн. восприимчивость соотв. 1,760 . 10 -3 (23,7 К) и 1,0200 . 10 -5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа кислород кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а =
0,2849 нм, с =
1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а
=0,42151 нм, b=
0,29567 нм, с
=0,66897 нм, плотн. 2,548 г/см 3).
Растворимость кислорода при атмосферном и 293 К (в см 3 /см 3): в 0,031, 0,2201, 0,2557, 0,2313; растворимость в при 373 К 0,017 см 3 /см 3 ; растворимость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители кислород платиновая чернь и активный . в расплавленном состоянии поглощают значительные количества кислорода, например при 960 °С один объем поглощает ~22 объема кислород, который при охлаждении почти полностью выделяется. Способностью поглощать кислород обладают мн. твердые и оксиды, при этом образуются нестехиометрические соединения.
Кислород отличается высокой хим. активностью, образуя соединения со всеми элементами, кроме Не, Ne и Аr. Атом кислород в химических соединениях обычно приобретает электроны и имеет отрицательный эффективный заряд. Соединения, в которых электроны оттягиваются от кислород, крайне редки (напр., OF 2). С простыми веществами, кроме Au, Pt, Xe и Кr, кислород реагирует непосредственно при обычных условиях или при нагревании, а также в присутствии катализаторов. Реакции с проходят под действием электрического разряда или УФ излучения. В реакциях со всеми простыми веществами, кроме F 2 , кислород является .
Молtrekzhysq кислород образует три различные ионные формы, каждая из которых дает начало классу соед.: О - 2 - супероксидам, О 2 2- -
пeроксидам (см. . Пе-роксидные соединения органические), О + 2 - диоксигенильным соeдинениям.
Озон образует .ды, в которых ионная форма кислород-О - 3 . О 2 присоединяется как слабый к некоторым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет . который осуществляет перенос кислород в организме теплокровных.
Реакции с кислородом, сопровождающиеся интенсивным выделением энeргии, называют горением.
Большую роль играют взаимодействие кислорода с металлами в присутствии влаги-атм. . а также дыхание
живых организмов и гниение. В результате гниения сложные орг. вещества погибших животных и растений превращаются в более простые и в конечном счете в СО 2 и волу.
С водородом кислород реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н 2). При комнатной температуре реакция идет крайне медленно, в присутствии - сравнительно быстро уже при 80-100 °С (эту реакцию используют для очистки Н 2 и инертных газов от примеси О 2). Выше 550 °С реакция Н 2 с О 2 сопровождается .
Из элементов I гр. наиб. легко реагируют с кислород Rb и Cs, которые самовоспламеняются на воздухе, К, Na и Li реагируют с кислород медленнее, реакция ускоряется в присутствии паров воды. При сжигании (кроме Li) в кислород образуются пероксиды М 2 О 2 и супероксиды МО 2 . С элементами подгруппы IIа кислород реагирует сравнительно легко, например, Ва способен воспламеняться на при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты реакции в этих случаях - и пероксиды. С элементами подгруппы IIб кислород взаимод. с большим трудом, реакция кислород с Zn, Cd и Hg происходит только при более высоких температурах (известны породы, в которых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие от дальнейшего .
Элементы III гр. реагируют с кислород только при нагревании, образуя оксиды. Компактные Ti, Zr, Hf устойчивы к действию кислород С углеродом кислород реагирует с образованием СО 2 и выделением тепла (394 кДж/моль); с аморфным углеродом реакция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом кислород реагирует лишь выше 1200°С с образованием NO, который далее легко окисляется кислород до NO 2 уже при комнатной температуре. Белый фосфор склонен к самовозгоранию на при комнатной температуре.
Элементы VI гр. S, Se и Те реагируют с кислородом с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой температуре.
Кислород энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате реакции кислород с углеводородами.
Получение.
В промышленности кислород получают воздуха разделением,
гл. обр. методом низкотемпературной ректификации. Его производят также наряду с Н 2 при пром. электролизе воды. Выпускают газообразный технол. кислород (92-98% О 2), техн. (1-й сорт 99,7% О 2 , 2-й сорт 99,5% и 3-й сорт 99,2%) и жидкий (не менее 99,7% О 2). Производится также кислород для лечебных целей ("медицинский кислород", содержащий 99,5% O 2).
Для в замкнутых помещениях (подводные лодки, космические аппараты и др.) используют твердые источники кислород, действие которых основано на самораспространяющейся экзотермической реакции между носителем кислород (хлоратом или перхлоратом) и горючим. Например, смесь NaClO 3 (80%), порошка Fe (10%), ВаО 2 (4%) и стекловолокна (6%) прессуют в виде цилиндров; после поджигания такая кислородная свеча горит со скоростью 0,15-0,2 мм/с, выделяя чистый, пригодный для кислород в кол-ве 240 л/кг (см. Пиротехнические источники газов
).
В лаборатории кислород получают разложением при нагревании оксидов (напр., HgO) или кислородсодержащих солей (напр., КСlO 3 , КМnО 4), а также электролизом водного раствора NaOH. Однако чаще всего используют пром. кислород, поставляемый в баллонах под давлением.
Определение.
Концентрацию кислород в газах определяют с помощью ручных газоанализаторов, например волюмометрическим методом по изменению известного объема анализируемой пробы после поглощения из нее О 2 растворами - медноаммиачным, пирогаллола, NaHSO 3 и др. Для непрерывного определения кислород в газах применяются автоматические термомагнитные газоанализаторы, основанные на высокой магнитной восприимчивости кислород Для определения малых концентраций кислород в инертных газах или водороде (менее 1%) используют автоматич. термохим., электрохим., гальванич. и др. газоанализаторы. С этой же целью применяют колориметрич. метод (с использованием прибора Мугдана), основанный на окислении бесцв. аммиачного комплекса Cu(I) в яркоокрашенное соед. Cu(II). Кислород, растворенный в воде, определяют также колориметрически, например по образованию красного окрашивания при окислении восстановленного индигокармина. В орг. соед. кислород определяют в виде СО или СО 2 после высокотемпературного пиролиза анализируемого вещества в потоке инертного газа. Для определения концентрации кислород в стали и сплавах используют электрохим. датчики с твердым электролитом (стабилизированный ZrO 2). См. также Газовый анализ, Газоанализаторы
.


